استخدام التبخير الحيوي في الحد من امراض النبات
الدكتور طارق عبد السادة
قسم وقاية النبات – كلية الزراعة – جامعة بغداد
tariqask@coagri.uobaghdad.edu.iq

يعود استخدام مصطلح التبخير الحيوي Biofumigation الى عام 1993 والذي يشير الى عملية زراعة وتحليل ودمج نباتات العائلة الصليبية العائدة لجنس Brassica spp. او الاجناس النباتية القريبة منها في التربه والذي يقود الى اطلاق مركبات الايزوثايوسيانات Isothiocynate (ITCs) خلال عملية التحلل المائي Hydrolysis لمركبات كلايكوسنيوليت Glucosinolate (GSTs) الموجودة في انسجة هذه النباتات Kirkegaard) واخرون ,1993). ونتيجة لذلك فان للتبخير الحيوي القدرة على كبح مدى واسع من الافات والمسببات المرضية التي تحمل في التربة. ان التبخير الحيوي يمكن ان يعد البديل الطبيعي للتبخير الكيمياوي Chemical fumigation كاستخدام مبيد Metham Sodium الذي يطلق مثيل-الايزوثايوسيانات Methyl-ITC لمكافحة العديد من المسبببات المرضية المتواجدة في التربة .
طرق عمل محاصيل التبخير الحيوي Mode of action of Biofumigant crops
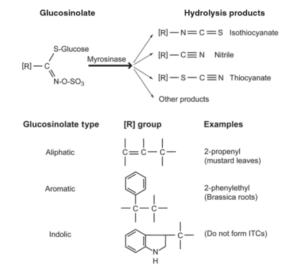
ان العديد من الانواع النباتيه العائده للعائلة الصليبيه Crucifera تنتج مستوى عالي من مركبات الكلايكوسينوليت GSLs التي تكون محجوزة بشكل منفصل عن انزيم ميروسينيز Myrosinase في الخلايا النباتيه والتي تكون بحد ذاتها غير قاتلة للفطريات Manici) واخرون ،1997 (. ونتيجة تمزق جدران الخلايا النباتيه مما يؤدي ذلك الى تلامس مركبات الكلايكوسيوليت GSLs وانزيم الميروسينيز وبوجود الماء الذي يعمل على تحللها بعملية التحلل المائي Hydrolysis واطلاق العديد من مركبات الايزوثايوسيانات ITCs كما في شكل 1 ( Vig واخرون ،2009 ).
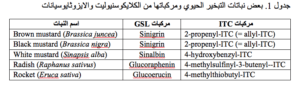
ان مركبات الايزوثايوسيانات ITCs تمتلك مدى واسع من خصائص المبيد الاحيائي Biocidal وهي فعلياً تعد كمواد سامة للعديد من الافات والمسببات المرضية ( chew ، 1987). ومن النباتات التي يمكن استخدامها في التبخير الحيوي هي انواع الخردل البني Brown Mustards والخردل الابيض White Mustard والفجل Radish والجرجير Rochet التي تحتوي على مركبات مختلفة من الكلايكوسينوليت GSLS وبالتالي يؤدي الى اطلاق مركبات الايزوثايوسيانات ITCS المختلفة . ان الاصناف النباتية المختلفة او الاجزاء النباتية المختلفة تحتوي على كميات مختلفة من صور مركبات الكلايكوسينوليت GSLS كما في جدول 1 ( potter واخرون ، 2000).
ولقد جرت العديد من التجارب لغرض تحسين عملية التبخير الحيوي فلقد تم ملاحظة ان الاثار المفيدة من هذه العملية ليست دائما متعلقه بفعالية مركبات الكلايكوسينوليت بل توجد الايات اخرى مكملة او تكون اكثر اهمية في كبح المسببات المرضية . وربما يعود ذلك الى دمج كميات كبيره من المواد العضوية في التربة مما يؤدي الى تحسين نسجة التربه وزيادة توفر المواد الغذائية وزيادة القدره على الاحتفاظ بالماء وتحفير مجتمعات الاحياء المجهرية المفيدة والتي تؤدي الى كبح مسببات امراض النبات والافات الاخرى.
ان من بين الاجناس الفطرية المتواجدة في التربة والتي تم مكافحتها باستخدام التبخير الحيوي كما اشار Matthiesseen وKirkegaard )2006 ) و Motisi واخرون )2010) هي :
Aphanomyces, Fusarium, Gaumannomyces, Phytophthora, Pythium, Rhizoctonia, Sclerotinia و Verticilliumواجناس النيماتودا Globodera و Meloidogne و Pratylenchus و Tylenchus.
واشارت بعض الدرسات المختبرية الى ان المسببات المرضية تختلف في حساسيتها لمركبات الايزوثيوسيانات ITCsالمختلفة وحسب مراحل نموها المختلفة مثل مرحلة تكوين الغزل الفطري والسبورات والاجسام الحجرية والتراكيب التكاثرية الاخرى . ومن هذا فإن اختلاف المسببات المرضية المتواجدة في كل تربة يتطلب دراسة واختبار نوع معين من محاصيل التبخير الحيوي للحصول على افضل النتائج في القضاء على المسببات المرضية. كما جرت العديد من التجارب في العراق على استخدام التبخير الحيوي اذ وجد ان استخدام اوراق الفجل وطحين بذور الفجل بعدة تراكيز كانت فعالة وبشكل معنوي في حماية نباتات الباذنجان من خطر الاصابة بالمعقد المرضي للفطر Fusarium oxysporum والنيماتودا Meloidogyne spp. (Hassan واخرون ، 2016 ). كما بين اختبار اوراق اللهانة الخضراء فعاليتها في خفض شدة الاصابه بمرض ذبول الفلفل الناجم عن الفطر Fusarium oxysporum ( كريم واخرون ، 2016). كذلك ثبتت فعالية مخلفات القرنابيط في خفض النسبة المئوية للاصابة بالفطر Fusarium oxysporum وحماية نباتات الفلفل من الاصابة بمرض الذبول الوعائي ( كريم واخرون ، 2015 ).
كيفية استخدام محاصيل التبخر الحيوي
يمكن استخدام محاصيل التبخير الحيوي بطرق مختلفة لغرض السيطرة على مسببات الامراض
- امكانية التداخل مع المحاصيل الزراعية المرغوبة او استخدامها في الدورة الزراعية
تستخدم مركبات الكلايكوسينوليت GSLS والايزوثايوسيانات ITCS او غيرها من المركبات والتي يمكن الحصول عليها من عملية غسل بقايا النباتات كالاوراق او من خلال افراز جذور النباتات في قمع مسببات الامراض والافات الاخرى ( Van Dam واخرون ، 2009) مع وجود نشاط للاحياء المجهرية المفيدة وبوجود فعالية انزيم الميروسينيز التي تعمل على تحويل مركبات الكلايكوسينوليت GSLs الى مركبات الايزوثيوسيانات ITCs . كذلك ممكن ان تؤثر على تواجد الاحياء المجهرية في منطقة الرايزوسفير Rhizosphere اذ لوحظ ازدياد تواجد بعض الفطريات المفيدة في مكافحة المسببات المرضية مثل الفطر Trichoderma الذي اظهر تحمل عالي لمركبات الايزوثيوسيانات ITCs ( Galetti واخرون ،2008) .
- عملية خلط محاصيل التبخير الحيوي بالتربة هي الطريقة الاكثر استخداما اذ يزرع محصول متخصص لغرض خلطة في التربه من اجل تحويل مركبات الكلايكوسينوليت واطلاق مستويات مرتفعة من مركبات الايزوثايوسيانات ITCs. وان عملية التحلل الشامل لانسجة النباتات المستخدمة في التبخير الحيوي يتطلب سرعة الخلط مع التربة ومن ثم سقاية التربة لضمان حصول التحلل المائي. ونظرا لكون قسم من مركبات الايزوثايوسيانات ITCs تكون سريعة التطاير مما يتطلب عملية تغطية للتربه بغطاء بلاستيك مثل المالج Mulch وذلك للاستفادة القصوى من العملية المنشوده (Kirkegaard و Matthiessen ، 2004).
- استخدام طحين بذور محاصيل التبخير الحيوي والتي يمكن الحصول عليها بعد عملية استخلاص زيوت بذور الصليبيات(كما في بذور الخردل) والتي تقدم مصدر غني ومناسب من المركبات الكلايكوسينوليت GSLs وكذلك احتوائها على انزيم الميزوسينيز اللازم لاتمام عملية التحلل المائي في التربة (Mazzola واخرون،2007) كذلك يمكن تجفيف نباتات التبخير الحيوي وتصنيعها بشكل بلت pellets ايضا تبين انها كانت فعالة في مكافحة الفطر Pythium وRhisoctonia (Lazzeri واخرون ،2004). وان الفائدة من هذه العملية هي اتاحة الفرصة لاستخدام منتجات محاصيل التبخير الحيوي في بعض اوقات السنة دون الحاجه لانتظار الوقت المناسب لزراعة هذه المحاصيل. ان طحين بذور المحاصيل التبخير الحيوي قد تكون اكثر ملائمة في المساحات الزراعية المحدودة مثل البيوت البلاستيكيه او الانفاق او مكافحة اصعب المسببات المرضية مثل الفطر Verticillium dahlia (Neubauer واخرون ،2014).
4- استخدامها كاسمدة خضراء Green manures ان استخدام محاصيل التبخير الحيوي يمكن ان تكون لها فوائد اضافية لما تحتوية من مركبات الايزوثايوسيانات ITCs والتي تستخدم في قمع مسببات الامراض وتؤدي الى زيادة المواد العضوية في التربة وتحسين نسجة التربة وتحرير العناصر الغذائية في التربة وتزيد من قوة نمو النباتات وبالتالي تؤثر بصورة غير مباشرة على مسببات الامراض (Jaffee واخرون ،1998).
طرق الاستفادة القصوى من استخدام المبخرات الحيوية في قمع المسببات المرضية :
1- ثباتية العلاقة بين مستوى مركبات الكلايكوسينوليت GSLs ومركبات الايزوثايوسيانات ITCs وقمع المسببات المرضية.ان النشاط المختلف لمحاصيل التبخير الحيوية تحتاج الى مسح لغرض معرفة فعاليتها ضد المسببات المرضية ويمكن ان يتم ذلك من خلال التجارب المختبرية مع التركيز على تراكيب المسببات المرضية المقاومه للظروف البيئية مثل السبورات الكلاميدية والاجسام الحجرية والتي تتواجد عادة في التربة لغرض تحديد افضل محاصيل التبخير الحيوي لمكافحة مسبب مرض معين قبل الذهاب الى التجارب الحقلية التي تكون مكلفة عادة (downie واخرون , 2012).
2- اختيار انسب محاصيل التبخير الحيوي او احد منتجاتها مع الاخذ بنظر الاعتبار فعاليتها ضد المسببات المرضيه المستهدفة فمثلا انواع العائدة للعائلة الصليبية تعطي مركبات الايزوثايوسيانات ITSC ذات السلاسل الليفاتيه الصغيره والتي تكون اكثر فعالية من المركبات ذات السلاسل العطرية الطويلة بسبب زيادة تبخرها وانخفاض امتصاصها من قبل المواد العضوية الموجودة في التربه. كذلك محاصيل التبخير الحيوي يجب اختيارها بما يلائم قساوة الظروف البيئية في فصل الشتاء ومعدل نموها ومحتواها في مركبات الكلايكوسينوليت GSLs في اوقات مختلفة من السنة والاخذ بنظرالاعتبار وقت خلطها في التربة .
3- استخدام الهندسة الوراثية لغرض انتاج كتله حيويه كبيره من محاصيل التبخير الحيوي المطلوب او زيادة عدد البذور المنتجه وتغيير مواعيد الزراعه وعمليات التسميد وافضل وقت لخلط المحاصيل التبخير الحيوي كل ذلك يتطلب النظر فيه من اجل تحقيق اقصى قدر من انتاج محاصيل التبخير الحيوي ومستوى مركبات الكلايكوسنوليت GSLs ( Li واخرون ,2007).
4- نمو وخلط كميات كبيرة من الكتله الحيوية من محاصيل التبخير الحيوي.فلقد اقترح استخدام نسبة 5% وزن/وزن من الكتله الحيوية الخضراء لغرض القضاء على المسببات المرضية.
5- تعظيم فعالية دمج محاصيل التبخير الحيوي واطلاق مركبات الايزوثايوسيانات ITCs .ان تمزق خلايا النباتات هو المفتاح الرئيسي لتحويل مركبات الكلايكوسينوليت GSLs الى مركبات الايزوثايوسيانات ITCs وهذا يعتمد على معدات تقطيع وسحق النباتات وسرعة خلطها مع التربة واضافة كميات من المياه وتغطية التربة بالاغطية البلاستيكية مما يعطي اعلى مستوى من مركبات الايزوثايوسيانات ITCs.
6- ترك الاراضي المعاملة بمنتجات نباتات التبخير الحيوي فترة من 1 – 2 اسبوع قبل زراعة المحاصيل المطلوبة وذلك لكون مركبات الايزوثايوسيانات ITCs ومركبات الكلايكوسنوليت GSLs المتحلله قد تمتلك سمية نباتيه ضد المحاصيل الاحقه.
عموما البحوث المتعلقة بالتبخير الحيوي من اجل السيطرة على مسببات الامراض لم تشكل مساحة كبيرة من العمل وكذلك عدم وجود منهج تجريبي واضح وبالتالي فقد تنوعت مستويات السيطرة الى حد كبير بين مختلف الافات المستهدفة وقد تعتبر هذه واحده من الاسباب الرئيسية من عدم انتشار استخدام التبخير الحيوي على نطاق تجاري. ولكن العديد من مناهج المكافحة التي تستخدم المبيدات الكيميائية التقليدية اصبحت مقيدة او محضورة الاستخدام وهذا قد يهيئ فرصة لزيادة الاهتمام والتمويل للاستثمار في هذا المجال. ولعل من ابرز نقاط معوقات انتشار استخدام التبخير الحيوي هي:
1- انعدام الثقة بشان فعاليتها في الحد من المسببات المرضية والافات الاخرى.
2- هاجس الخوف من ازالة استخدام المبيدات الكيميائية المصنعة.
في حين يمكن زيادة الاعتماد على استخدام التبخير الحيوي من خلال :
1- زيادة المشورة وتبادل المعلومات بين المختصين في هذا المجال والمزارعين الذين يعتمدون على هذا الاسلوب من المكافحة.
2- زيادة البحوث على انتاج محاصيل التبخير الحيوي ذات المستوى العالي من مركبات الكلايكوسينوليت GSLs.
3- تفعيل تطبيقات الاسمدة المتعلقة بها .
4- التحكم بمواعيد زراعة واختيار المناسب من محاصيل التبخير الحيوي من قبل منتجي البذور.
5- توفر الالات الزراعية المثالية لغرض تقطيع وخلط ونقع محاصيل التبخير الحيوي.
المراجع
كريم , طارق عبدالسادة ، مينا وليد حاتم و ايمان خليل عبدالكريم. 2016 . مكافحة مرض الذبول الفيوزارمي في الفلفل الناجم عن الفطر Fusarium oxysporum باستخدام اوراق اللهانة (Cabbage (Brassica oleracea var. capitata بالتبخير الحيوي. مجلة مركز بحوث التقنيات الاحيائية.10(2): 12-15.
كريم , طارق عبدالسادة ، ايمان خليل عبدالكريم و مينا وليد حاتم.2015. التبخير الحيوي باستخدام مخلفات القرنابيط ضد الفطر Fusarium oxysporum مسبب ذبول الفلفل. Egypt. J.of Appl. Sci. . 30(11) : 338 – 345 .
Chew FS, 1987. Biologically active natural products – Potential use in agriculture. In: Comstock MJ, ed. ACS Symposium Series. USA: American Chemical Society.
Downie H, Holden N, Otten W, Spiers AJ, Velntine TA, Dupuy LX, 2012. Transparent soil for imaging the rhizosphere. PLoS One 7, e44276.
Galletti S, Sala E, Leoni O, Burzi PL, Cerato C, 2008. Trichoderma spp. tolerance to Brassica carinata seed meal for a combined use in biofumigation. Biological Control 45, 319-27.
Jaffee BA, Ferris H, Scow KM, 1998. Nematode-trapping fungi in organic and conventional cropping systems. Phytopathology 88, 344-50.
Hassan A K, Kareem TA and Matar SS. 2016. Effect of Biofumigation with Radish (Raphanus sativus) Leaves Fresh and Seed Meals to Control Root Knot Nematode and Fusarium wilt Disease Complex Infecting Eggplant. Journal of Biology, Agriculture and Healthcare. 6(4): 21 – 25.
Kirkegaard J, Matthiessen J, 2004. Developing and refining the biofumigation concept. Agroindustria 3, 233-239.
Kirkegaard JA, Gardner PA, Desmarchelier JM, Angus JF, 1993. Biofumigation – using Brassica species to control pests and diseases in horticulture and agriculture. In: Proceedings of the 9th Australian Research Assembly on Brassicas pp 77-8. N. Wratten and RJ Mailer eds.
Lazzeri L, Leoni O, Manici LM, 2004. Biocidal plant dried pellets for biofumigation. Industrial Crops and Products 20, 59-65.
Li S, Schonhof I, Krumbein A, Li L, Stützel H, Schreiner M, 2007. Glucosinolate concentration in turnip (Brassica rapa ssp. rapifera L.) roots as affected by nitrogen and sulfur supply. Journal of Agricultural and Food Chemistry 55, 8452-8457.
Manici LM, Lazzeri L, Palmieri S, 1997. In vitro fungitoxic activity of some glucosinolates and their enzyme-derived products toward plant pathogenic fungi. Journal of Agricultural and Food Chemistry 45, 2768-73.
Mazzola M, Brown J, Izzo AD, Cohen MF 2007. Mechanism of action and efficacy of seed meal-induced pathogen suppression differ in a Brassicaceae species and time-dependent manner. Phytopathology 97,454-460.
Matthiessen JN, Kirkegaard JA, 2006. Biofumigation and enhanced biodegradation: opportunity and challenge in soilborne pest and disease management. Critical Reviews in Plant Sciences 25, 235-65.
Motisi N, Doré T, Lucas P, Montfort F, 2010. Dealing with the variability in biofumigation efficacy through an epidemiological framework. Soil Biology and Biochemistry 42, 2044-57.
Neubauer C, Heitmann B, Müller C, 2014. Biofumigation potential of Brassicaceae cultivars to Verticillium dahliae. European Journal of Plant Pathology 140, 341–352.
Potter M, Vanstone V, Davies K, Rathjen A, 2000. Breeding to increase the concentration of 2-phenylethyl glucosinolate in the roots of Brassica napus. Journal of Chemical Ecology 26, 1811-20.
Van Dam N, Tytgat TG, Kirkegaard J, 2009. Root and shoot glucosinolates: a comparison of their diversity, function and interactions in natural and managed ecosystems. Phytochemistry Reviews 8, 171-86.
Vig, AP, Rampal G, Thind, TS, Arora S, 2009. Bio-protective effects of glucosinolates – A review. LWT – Food Science and Technology 42, 1561-72.


سلمت الايادي دكتور طارق